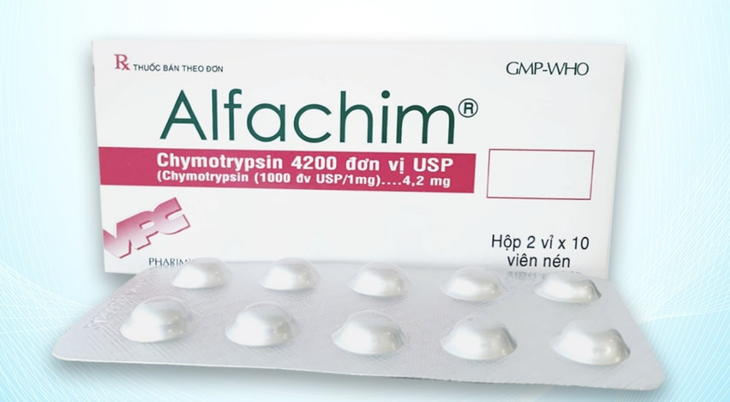
Cục Quản lý Dược – Bộ Y tế vừa ban hành quyết định thu hồi toàn bộ lô viên nén Alfachim 4.2 (Chymotrypsin 4 200 IU; số đăng ký VD‑34573‑20, số lô 03010624, sản xuất ngày 1 tháng 6 năm 2024, hạn dùng đến ngày 1 tháng 6 năm 2026) do Công ty Cổ phần Dược phẩm Cửu Long sản xuất. Trước đó, ngày 15 tháng 5 năm 2025, Cục chỉ yêu cầu thu hồi lô thuốc này tại Hà Nội sau khi Viện Kiểm nghiệm thuốc Trung ương phát hiện không đạt chỉ tiêu định lượng – mức độ vi phạm 2.
Công ty Cửu Long đã được yêu cầu gửi thêm hai mẫu xét nghiệm bổ sung trong vòng 15 ngày, nhưng chỉ cung cấp dữ liệu về quy trình sản xuất, phân phối và thu hồi, không có kết quả kiểm nghiệm mới. Vì vậy, doanh nghiệp đã đề nghị tự nguyện thu hồi toàn quốc lô thuốc này và được Cục Quản lý Dược chấp thuận, ban hành quyết định chính thức.
Theo quy định, Công ty Dược phẩm Cửu Long phải phối hợp với hệ thống phân phối thực hiện việc thu hồi trong vòng 2 ngày kể từ khi có công văn, đồng thời báo cáo đầy đủ trong vòng 18 ngày. Báo cáo phải thể hiện số lượng sản xuất, phân phối, lượng đã thu hồi và bằng chứng tại từng cơ sở bán buôn, bán lẻ và nơi sử dụng.
Cục Quản lý Dược đã chỉ đạo Sở Y tế các tỉnh, đặc biệt là Hà Nội và Vĩnh Long – nơi đặt trụ sở và nhà máy của công ty – giám sát chặt chẽ quá trình thu hồi, phổ biến thông tin và xử lý nghiêm nếu phát hiện vi phạm. Các địa phương cũng phải đánh giá hiệu quả của việc thu hồi, kiểm tra xem thuốc còn bị lưu hành hay không.
Việc phát hiện và thu hồi kịp thời lô thuốc không đảm bảo chất lượng cho thấy hệ thống giám sát dược phẩm đang hoạt động hiệu quả. Alfachim 4.2 chứa enzyme Chymotrypsin, được sử dụng trong điều trị viêm và phù nề sau chấn thương hoặc phẫu thuật. Sử dụng thuốc không đúng chất lượng có thể làm giảm hiệu quả điều trị và ảnh hưởng xấu đến sức khỏe người dùng.
Theo Cục Quản lý Dược, biện pháp thu hồi này là cần thiết để bảo vệ người sử dụng và cũng là lời cảnh báo cho các doanh nghiệp tăng cường kiểm soát chất lượng sản phẩm trước khi đưa ra thị trường.
Theo Tuổi Trẻ Online